Инструкция на Пралуэнт 150 мг/мл, раствор для подкожного введения, 2 мл, 1 шт.
Состав
| Раствор для подкожного введения | 1 шприц/шприц-ручка |
| активное вещество: | |
| алирокумаб | 75/150 мг |
| вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат — 1,241*/0,931* мг; сахароза — 100/100 мг; полисорбат20 — 0,1/0,1 мг; вода для инъекций — до 1/1 мл | |
| * Суммарное количество L-гистидина и L-гистидина гидрохлорида моногидрата в пересчете на L-гистидин. |
Описание
Прозрачная или слегка опалесцирующая, бесцветная или желтоватого цвета жидкость.
Фармакодинамика
Алирокумаб является полностью человеческим моноклональным антителом (изотип IgG1), мишенью которого является фермент пропротеиновая конвертаза субтилизин-кексин типа 9 (PCSK9). Алирокумаб производится с помощью технологии рекомбинантной ДНК с использованием суспензионной культуры клеток яичника китайского хомячка.
Алирокумаб имеет молекулярную массу приблизительно 146 кДа.
Механизм действия. PCSK9 связывается с рецепторами ЛПНП (Р-ЛПНП) на поверхности гепатоцитов, способствуя деградации Р-ЛПНП в печени. Р-ЛПНП являются главными рецепторами, которые выводят из системного кровотока циркулирующие ЛПНП, поэтому уменьшение количества Р-ЛПНП при связывании их с PCSK9 приводит к повышению концентрации Хс-ЛПНП в крови. Ингибируя связывание PCSK9 с Р-ЛПНП, алирокумаб увеличивает количество Р-ЛПНП для выведения ЛПНП, снижая таким образом концентрации Хс-ЛПНП в крови.
Р-ЛПНП также связывают богатые триглицеридами (ТГ) ремнантные ЛПОНП и липопротеины промежуточной плотности (ЛППП). Поэтому лечение алирокумабом может снижать концентрации этих ремнантных липопротеинов, о чем свидетельствует их уменьшение в аполипопротеине В (апо В), Хс липопротеинов, не являющихся липопротеинами высокой плотности (Хс-ЛПнеВП) и ТГ. Алирокумаб также снижает концентрации липопротеинов а (Лп(а), являющихся формой ЛПНП, которые связаны с апо А. Однако было показано, что Р-ЛПНП имеют низкую аффинность к Лп(а), в связи с чем точный механизм, с помощью которого алирокумаб снижает Лп(а), полностью не установлен.
Генетические исследования
В генетических исследованиях, проведенных у человека, были выявлены разновидности гена PCSK9 с мутациями потери или повышения функции. У пациентов с одним аллелем PCSK9 с мутацией потери функции отмечались более низкие концентрации Хс-ЛПНП, которые коррелировали со значительно более низкой частотой развития ИБС. У некоторых пациентов были выявлены мутации потери функции в двух аллелях, и у них отмечались очень низкие концентрации Хс-ЛПНП в крови с концентрациями в крови Хс-ЛПВП и ТГ в нормальном диапазоне. Наоборот, мутации повышения функции в гене PCSK9 были выявлены у пациентов с повышенными концентрациями Хс-ЛПНП в крови и клиническим диагнозом семейной гиперхолестеринемии.
Наблюдательный анализ показал, что без лечения концентрации Хс-ЛПНП в крови у пациентов с мутациями повышения функции в гене PCSK9 находились в диапазоне, подобном наблюдавшемуся у пациентов с более часто встречающимися мутациями, вызывающими гетерозиготную форму семейной гиперхолестеринемии (такими как мутации в гене Р-ЛПНП), демонстрируя центральную роль фермента PCSK9 в метаболизме Хс-ЛПНП и его концентрациях в крови. В многоцентровом двойном слепом плацебо-контролируемом исследовании (продолжительностью 14 нед) 13 пациентов с гетерозиготной формой семейной гиперхолестеринемии, связанной с мутацией повышения функции в гене PCSK9, были рандомизированы в 2 группы: группу, получающую алирокумаб в дозе 150 мг 1 раз в 2 нед, и группу, получающую плацебо.
Среднее значение концентрации Хс-ЛПНП в крови составляло 151,5 мг/дл. На 2-й нед лечения среднее значение снижения исходной концентрации Хс-ЛПНП в крови составило 62,5% в группе пациентов, получавших алирокумаб, по сравнению с 8,8% у пациентов, получавших плацебо. На 8-й нед лечения среднее значение снижения концентрации Хс-ЛПНП в крови от исходного значения у всех пациентов, получавших алирокумаб, составило 72,4%.
Фармакодинамические свойства
Алирокумаб является полностью человеческим моноклональным антителом, которое подавляет активность PCSK9 как в исследованиях in vitro, так и в системах моделей in vivo. Большое количество исследований, проведенных у человека и животных, продемонстрировали центральную роль, которую играют повышенные концентрации Хс-ЛПНП в крови в возникновении и прогрессировании атеросклероза. Другие липопротеины, содержащие апо В-100, особенно богатые триглицеридами ремнантные липопротеины (образовавшиеся из ЛПОНП и ЛППП) и Лп(а), также считаются способствующими развитию атеросклероза. Однако проведенные до настоящего времени исследования не выявили независимого влияния снижения концентраций этих липопротеинов на сердечно-сосудистую заболеваемость и смертность.
В исследованиях in vitro алирокумаб не индуцировал антителозависимую клеточноопосредованную токсичность и комплементзависимую цитотоксичность (Fc-опосредованную эффекторную функцию), как в присутствии, так и в отсутствии PCSK9. У алирокумаба, связанного с PCSK9, не наблюдалось образования нерастворимых иммунных комплексов, способных связывать протеины комплемента.
Клиническая эффективность/клинические исследования
Резюме клинических исследований III фазы с использованием режима дозирования 75 и/или 150 мг каждые 2 нед (Q2W). Эффективность алирокумаба была изучена в 10 исследованиях III фазы (5 плацебо-контролируемых и 5 эзетимиб-контролируемых исследований), включавших 5296 рандомизированных пациентов с гиперхолестеринемией (несемейной и гетерозиготной формой семейной) или смешанной гиперхолестеринемией, из них 3188 пациентов были рандомизированы для приема алирокумаба. Три из этих 10 исследований были проведены исключительно у пациентов с гетерозиготной формой семейной гиперхолестеринемии. Большинство пациентов принимали одновременно липидмодифицирующую терапию, состоящую из максимально переносимых доз статинов в сочетании или без сочетания с другими липидмодифицирующими видами лечения и имели высокий и очень высокий сердечно-сосудистый риск. Два исследования были проведены у пациентов, которые не получали одновременно статины, включая одно исследование у пациентов с документированной непереносимостью статинов.
Два исследования (LONG TERM и HIGH FH), включающие в общей сложности 2416 пациентов, были проведены только с дозой 150 мг 1 раз в 2 нед. Восемь исследований были проведены с дозой 75 мг 1 раз в 2 нед и критерием для повышения дозы до 150 мг 1 раз в 2 нед на 12-й нед было недостижение пациентами целевого значения концентрации Хс-ЛПНП в крови, основанного на степени их сердечно-сосудистого риска на 8-й нед лечения.
Главной конечной точкой эффективности во всех клинических исследованиях III фазы было среднее значение снижения концентрации Хс-ЛПНП в крови на 24-й нед по сравнению с плацебо и эзетимибом. Все исследования достигли своей главной конечной точки.
В целом применение алирокумаба приводило также к статистически значимо большему значению процента снижения концентраций общего Хс (ОХ), Хс-ЛПнеВП, апо B и Лп(а) по сравнению с плацебо/эзетимибом, независимо от того получали или нет пациенты статины. Алирокумаб также снижал концентрации ТГ и увеличивал концентрации Хс-ЛПВП и апо А-1 по сравнению с плацебо.
Результаты по эффективности были единообразными у пациентов с гетерозиготной формой семейной гиперхолестеринемии, без гетерозиготной семейной гиперхолестеринемии, у пациентов со смешанной дислипидемией и пациентов с сахарным диабетом. Снижение концентраций Хс-ЛПНП в крови было единообразным, независимо от того, принимались или не принимались пациентами одновременно статины, и от доз последних.
После прекращения введения алирокумаба не наблюдалось синдрома отмены и концентрация Хс-ЛПНП в крови постепенно возвращалась к исходным показателям.
Исследование CHOICE I с использованием режима дозирования 300 мг каждые 4 нед (Q4W). Исследование CHOICE I — многоцентровое двойное слепое плацебо-контролируемое 48-недельное исследование, которое включало 540 пациентов, получающих максимально переносимую дозу статина с или без другой липидмодифицирующей терапии, и 252 пациента, не получавших статины. Пациенты были случайным образом распределены в группы лечения алирокумабом в дозе 300 мг Q4W, алирокумабом в дозе 75 мг Q2W или плацебо. 71,6% пациентов относились к категориям высокого или очень высокого сердечно-сосудистого риска. Все пациенты не имели целевых значений Хс-ЛПНП при включении в исследование. В группах алирокумаба доза могла быть скорректирована до 150 мг Q2W на 12-й нед у пациентов с сохраняющимся уровнем Хс-ЛПНП ≥70 мг/дл или ≥100 мг/дл в зависимости от их степени сердечно-сосудистого риска или у пациентов, у которых не отмечалось уменьшение Хс-ЛПНП на 30% от исходного уровня.
В когорте пациентов, принимавших статины, средняя исходная концентрация Хс-ЛПНП составила 112,7 мг/дл. На 12-й нед среднее процентное изменение от исходных значений Хс-ЛПНП в группе алирокумаб 300 мг Q4W составило 55,3% по сравнению с +1,1% для плацебо, при этом 77,3% пациентов, получавших алирокумаб 300 мг Q4W, достигли концентрации Хс-ЛПНП <70 мг/дл по сравнению с 9,3% в группе плацебо.
Увеличение дозы алирокумаба до 150 мг Q2W на 12-й нед потребовалось у 19,3% пациентов этой когорты. На 24-й нед среднее процентное изменение от исходных значений Хс-ЛПНП в группе алирокумаб 300 мг Q4W/150 мг Q2W составило −58,8% по сравнению с −0,1% для плацебо.
В когорте пациентов, не получавших сопутствующей терапии статинами, средняя исходная концентрация Хс-ЛПНП составляла 142,1 мг/дл. На 12-й нед среднее процентное изменение Хс-ЛПНП от исходного значения в группе алирокумаба 300 мг Q4W составило −58,4% по сравнению с +0,3% для группы плацебо, при этом 65,2% пациентов, получавших алирокумаб 300 мг Q4W, достигли концентрации Хс-ЛПНП <70 мг/дл по сравнению с 2,8% в группе плацебо. Увеличение дозы алирокумаба до 150 мг Q2W на 12-й нед потребовалось у 14,7% пациентов этой когорты. На 24-й нед среднее процентное изменение от исходных значений Хс-ЛПНП в группе алирокумаб 300 мг Q4W/150 мг Q2W составило −52,7% по сравнению с −0,3% для группы плацебо. В обеих когортах пациентов различие по сравнению с плацебо было статистически значимым на 24-й нед для всех параметров липидного обмена, за исключением апо А-1 в подгруппе пациентов, принимавших статины.
Фармакокинетика
Абсорбция. После п/к введения препарата Пралуэнт в дозе от 50 до 300 мг среднее время достижения Cmax алирокумаба в сыворотке крови составляло 3–7 дней.
Фармакокинетика алирокумаба после однократного п/к введения в дозе 75 мг в область живота, бедра или плеча была подобной. По данным популяционного анализа фармакокинетических показателей, абсолютная биодоступность алирокумаба после п/к введения составляла 85%.
Незначительно большее (2,1–2,7-кратное), чем пропорциональное дозе, увеличение концентраций алирокумаба наблюдалось при двукратном увеличении дозы с 75 до 150 мг 1 раз в 2 нед.
Равновесное состояние достигалось после введения 2–3 доз с двукратным коэффициентом накопления.
Месячная экспозиция алирокумаба при применении в дозе 300 мг каждые 4 нед аналогична таковой при применении дозы 150 мг каждые 2 нед.
Распределение. После в/в введения Vd алирокумаба составлял 0,04–0,05 л/кг, что указывает на распределение алирокумаба главным образом в системе кровообращения.
Метаболизм. Специальные исследования метаболизма не проводились, т.к. алирокумаб является белком. Предполагается, что алирокумаб расщепляется на небольшие пептиды и отдельные аминокислоты.
Выведение. У алирокумаба наблюдались 2 фазы выведения. В низких концентрациях элиминация происходит преимущественно через насыщаемую связь с мишенью (PCSK9), в то время как при более высоких концентрациях элиминация алирокумаба происходит преимущественно через ненасыщаемый протеолитический путь. По данным популяционного анализа фармакокинетических показателей, средний T1/2 алирокумаба составлял 17–20 дней у пациентов, получавших алирокумаб в монотерапии п/к в дозах 75 мг 1 раз в 2 нед или 150 мг 1 раз в 2 нед. При одновременном применении со статинами средний T1/2 алирокумаба составлял 12 дней.
Особые группы пациентов
Пол. По данным популяционного анализа фармакокинетических показателей, половая принадлежность пациентов не влияла на фармакокинетику алирокумаба.
Пожилой возраст. По данным популяционного анализа фармакокинетических показателей, возраст ассоциировался с небольшим различием в системной экспозиции алирокумаба в равновесном состоянии без влияния на его эффективность и безопасность.
Масса тела. По данным популяционного анализа фармакокинетических показателей, масса тела оказывала незначительное влияние на системную экспозицию алирокумаба без влияния на его эффективность и безопасность.
Дети. Фармакокинетические эффекты алирокумаба у пациентов детского возраста к настоящему моменту не изучались.
Нарушения функции печени. В клиническом исследовании I фазы при однократном п/к введении алирокумаба в дозе 75 мг фармакокинетические показатели алирокумаба у пациентов с печеночной недостаточностью легкой и средней степени тяжести были аналогичными таковым у пациентов с нормальной функцией печени. Доступные данные по фармакокинетике алирокумаба у пациентов с печеночной недостаточностью тяжелой степени отсутствуют.
Нарушения функции почек. Так как нет сведений о том, что моноклональные антитела выводятся почками, не ожидается, что функциональное состояние почек повлияет на фармакокинетику алирокумаба.
Популяционный анализ фармакокинетических показателей продемонстрировал, что нарушение функции почек легкой и средней степени тяжести не оказывало значимого воздействия на фармакокинетику алирокумаба. Данные по фармакокинетике алирокумаба у пациентов с тяжелыми нарушениями функции почек ограничены.
Расовая принадлежность. По данным популяционного анализа фармакокинетических показателей, расовая принадлежность не оказывала влияния на фармакокинетику алирокумаба. После однократного п/к введения алирокумаба в дозах 100–300 мг не наблюдалось значимых различий в системной экспозиции у здоровых добровольцев, являющихся японцами и представителями белой расы.
Пралуэнт: Показания
Препарат Пралуэнт показан для длительного лечения взрослых пациентов с первичной гиперхолестеринемией (несемейной и гетерозиготной формой семейной гиперхолестеринемии) или смешанной дислипидемией, включая пациентов с сахарным диабетом типа 2, в дополнение к диете, для снижения концентрации Хс-ЛПНП, общего Хс, Хс-ЛПнеВП, апо B, ТГ и ЛП(а) и повышения концентраций Хс-ЛПВП и апо А-1.
Препарат Пралуэнт показан:
- в комбинации со статинами (ингибиторы ГМГ-КоА-редуктазы) в сочетании или без сочетания с другой липидмодифицирующей терапией при невозможности достижения у пациентов целевой концентрации Хс-ЛПНП при приеме максимально допустимой дозы статинов;
- в монотерапии или как дополнение к другой, не содержащей статинов липидмодифицирующей терапии, у пациентов с непереносимостью статинов или при наличии противопоказаний к их применению.
Влияние препарата Пралуэнт на сердечно-сосудистую заболеваемость и смертность в настоящее время не установлено.
Способ применения и дозы
П/к. Начальная доза препарата Пралуэнт составляет 75 мг, которую вводят 1 раз в 2 нед или 300 мг 1 раз каждые 4 нед (ежемесячно). У пациентов, которым требуется большее снижение концентрации Хс-ЛПНП (>60%), начальная доза препарата Пралуэнт может составлять 150 мг, которую также вводят 1 раз в 2 нед.
Дозу препарата Пралуэнт следует подбирать индивидуально, на основании таких параметров, как исходные значения Хс-ЛПНП, цели терапии и ответ пациента на лечение. Концентрации липидов в крови можно оценивать через 4–8 нед после начала лечения или титрования дозы и проводить соответствующую коррекцию дозы. При необходимости дополнительного снижения концентрации Хс-ЛПНП у пациентов, которым препарат Пралуэнт назначался в дозе 75 мг 1 раз каждые 2 нед или 300 мг 1 раз каждые 4 нед, доза может быть скорректирована до максимальной дозы 150 мг 1 раз каждые 2 нед.
В случае пропуска дозы пациент должен получить инъекцию как можно скорее и затем продолжить лечение по исходной схеме.
Особые группы пациентов
Дети. Безопасность и эффективность применения препарата Пралуэнт у детей в возрасте до 18 лет не установлены.
Пожилой возраст. У пациентов пожилого возраста коррекции дозы препарата Пралуэнт не требуется (см. «Особые указания»).
Печеночная недостаточность. У пациентов с печеночной недостаточностью легкой или средней степени тяжести коррекции дозы препарата Пралуэнт не требуется.
Данные по применению препарата Пралуэнт у пациентов с печеночной недостаточностью тяжелой степени отсутствуют.
Почечная недостаточность. У пациентов с почечной недостаточностью легкой или средней степени тяжести коррекции дозы препарата Пралуэнт не требуется. Данные по применению препарата у пациентов с почечной недостаточностью тяжелой степени ограничены.
Масса тела. Не требуется коррекции режима дозирования в зависимости от массы тела пациентов.
Правила введения препарата
Препарат Пралуэнт применяют в виде п/к инъекций, проводимых в области бедра, живота или плеча, с помощью одноразовой предварительно заполненной шприц-ручки или одноразового предварительно заполненного шприца.
Рекомендуется менять места инъекций при проведении каждой инъекции.
При назначении дозы 300 мг препарат вводят в виде двух инъекций по 150 мг в разные места.
Препарат Пралуэнт не следует вводить в области активных кожных заболеваний или повреждений, таких как солнечные ожоги, кожная сыпь, воспаления кожи или кожные инфекции.
Не следует вводить препарат Пралуэнт в то же место, в которое вводились другие лекарственные препараты.
Описание предварительно заполненных одноразовых шприц-ручек и инструкция по их использованию
Пралуэнт, 75 мг, раствор для п/к введения в предварительно заполненной шприц-ручке.
Пралуэнт, 150 мг, раствор для п/к введения в предварительно заполненной шприц-ручке.
Инструкция по применению
Пациента необходимо информировать о том, что он должен сохранять эту инструкцию, т.к. она может понадобиться ему снова. Если у пациента появятся вопросы, то ему следует обратиться к лечащему врачу или провизору или позвонить по номеру телефона Представительства АО «Санофи-авентис груп», указанному в инструкции.
Части шприц-ручки указаны на рисунке
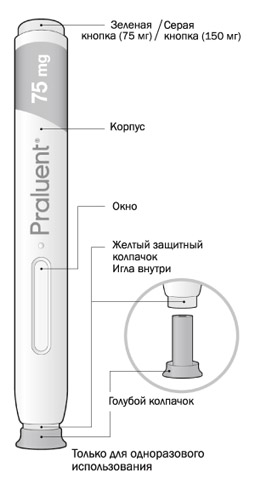
Важная информация
- шприц-ручка предназначена только для одноразового использования;
- шприц-ручка с зеленой кнопкой: в 1 мл раствора содержится 75 мг алирокумаба;
- шприц-ручка с серой кнопкой: в 1 мл раствора содержится 150 мг алирокумаба;
- препарат вводится п/к либо самим пациентом, либо другим лицом, ухаживающим за ним;
- шприц-ручку можно использовать только для одноразовой инъекции, и она должна быть утилизирована после применения.
Правила использования
- шприц-ручку следует хранить в недоступном для детей месте;
- перед использованием шприц-ручки следует внимательно прочитать инструкцию;
- необходимо следовать всем указаниям, представленным в инструкции, при каждом использовании шприц-ручки;
- неиспользованные шприц-ручки следует хранить в холодильнике при температуре от 2 до 8 °C.
Запрещено
- трогать желтый защитный колпачок;
- использовать шприц-ручку при протекании или повреждении;
- использовать шприц-ручку при отсутствии голубого колпачка или если он ненадежно закреплен;
- использовать шприц-ручку повторно;
- трясти шприц-ручку;
- замораживать шприц-ручку;
- подвергать шприц-ручку воздействию прямых солнечных лучей.
Этап А. Подготовка к введению
Перед введением препарата пациенту понадобятся:
- шприц-ручка с препаратом Пралуэнт;
- салфетки, смоченные спиртом;
- ватные тампоны или марля;
- контейнер, резистентный к проколам.
1. Проверить этикетку на шприц-ручке:
- убедиться, что взят правильный (нужный пациенту) препарат и правильная (нужная пациенту) доза (шприц-ручка с зеленой кнопкой — для дозы 75 мг/мл и шприц-ручка с серой кнопкой — для дозы 150 мг/мл);
- проверить срок годности. Не использовать по истечении срока годности.
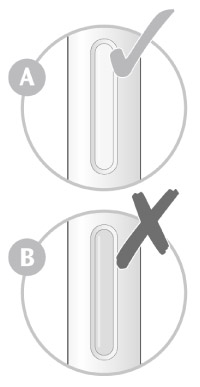
2. Проверить окно:
- проверить, чтобы видимая в окно жидкость была прозрачной и бледно-желтой, без включений. Если имеются изменения цвета и видимые включения, то не следует использовать шприц-ручку (см. рисунок А);
- пациент может увидеть пузырьки воздуха. Это нормальное явление, не влияет на дальнейшее использование препарата;
- не использовать шприц-ручку, если окно желтого цвета и не содержит жидкости (см. рисунок B).
3. Оставить шприц-ручку согреваться при комнатной температуре в течение 30–40 мин:
- не нагревать шприц-ручку, она должна согреться сама;
- использовать шприц-ручку как можно скорее после того, как она нагрелась;
- не класть шприц-ручку обратно в холодильник.
4. Подготовка места введения препарата:
- вымыть руки водой с мылом и вытереть их полотенцем;
- можно вводить препарат в область бедра, живота (за исключением области 5 см вокруг пупка), наружную поверхность плеча (см. рисунок);
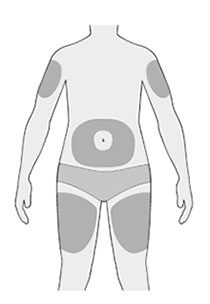
- пациент может стоять или сидеть во время введения препарата;
- продезинфицировать место введения салфеткой, смоченной спиртом;
- не вводить препарат в болезненную, уплотненную, покрасневшую или воспаленную кожу;
- не вводить препарат в места рядом с видимыми венами;
- использовать разные места при каждом введении препарата.
- не вводить препарат в одно и то же место с другими препаратами.
Этап B. Как вводить препарат
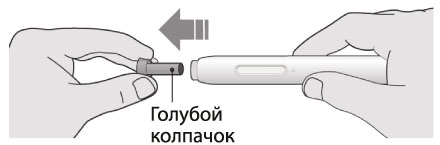
1. После завершения всех пунктов «Этап А. Подготовка к введению» снять голубой колпачок:
- не снимать колпачок до тех пор, пока пациент не будет готов к введению препарата;
- не надевать голубой колпачок обратно.
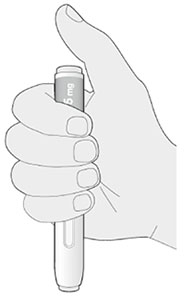
2. Держать шприц-ручку, как показано на рисунке:
- не трогать желтый защитный колпачок;
- убедиться, что видно окно.
3. Прижать желтый защитный колпачок к коже примерно под углом 90°:
- прижимать шприц-ручку к коже и удерживать ее так, чтобы желтый защитный колпачок стал невидимым (вдавленным в кожу). Шприц-ручка не будет работать, если желтый защитный колпачок не вдавлен в кожу полностью;
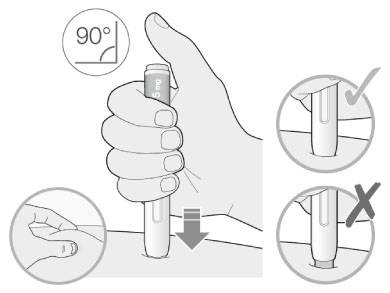
- при необходимости следует зажать кожу, чтобы убедиться, что место введения плотное.
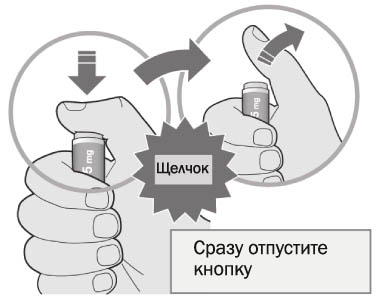
4. Нажать большим пальцем на зеленую (если используется шприц-ручка Пралуэнт, 75 мг) или серую кнопку (если используется шприц-ручка Пралуэнт, 150 мг) и сразу отпустить ее:
- будет слышен щелчок. Введение препарата началось;
- окно начнет желтеть.
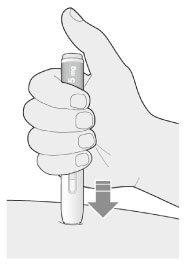
5. Продолжать удерживать шприц-ручку плотно прижатой к коже после того, как отпущена кнопка:
- введение препарата может продолжаться до 20 с.
6. Проверить, что окно стало желтого цвета до того, как убрана шприц-ручка с кожи:
- не убирать шприц-ручку с кожи до тех пор, пока все окно не будет желтого цвета;
- введение препарата завершено, после того как все окно будет желтого цвета и будет слышен второй щелчок;
- если окно не стало полностью желтого цвета, не следует вводить самостоятельно вторую дозу без консультации врача.

7. Убрать шприц-ручку с кожи:
- не растирать кожу после введения препарата;
- если пациент видит кровь, необходимо прижать ватный тампон или марлю и удерживать их до тех пор, пока не остановится кровотечение.

8. Утилизировать шприц-ручку и колпачок:
- не надевать голубой колпачок повторно;
- поместить шприц-ручку в контейнер, резистентный к проколам;
- всегда хранить контейнер в недоступном для детей месте.
Описание предварительно заполненных одноразовых шприцев и инструкция по их использованию
Пралуэнт, 75 мг, раствор для п/к введения в предварительно заполненном шприце.
Пралуэнт, 150 мг, раствор для п/к введения в предварительно заполненном шприце.
Части шприца показаны на рисунке.
Важная информация
Шприц предназначен для одноразового использования.
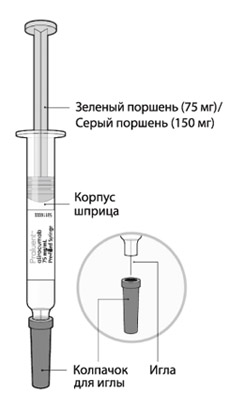
- шприц с зеленым поршнем: в 1 мл раствора содержится 75 мг алирокумаба;
- шприц с серым поршнем: в 1 мл раствора содержится 150 мг алирокумаба;
- препарат вводится п/к либо самим пациентом, либо другим лицом, ухаживающим за ним;
- шприц можно использовать только для однократной инъекции, и он должен быть утилизирован после использования.
Правила использования
- шприц следует хранить в недоступном для детей месте;
- перед использованием шприца следует внимательно прочитать инструкцию;
- необходимо следовать всем указаниям, представленным в инструкции, при каждом использовании шприца;
- неиспользованные шприцы следует хранить в холодильнике при температуре от 2 до 8 °C.
Запрещено
- трогать иглу;
- использовать шприц при протекании или повреждении;
- использовать шприц при отсутствии серого колпачка для иглы, или если он ненадежно закреплен;
- использовать шприц повторно;
- трясти шприц;
- замораживать шприц;
- подвергать шприц воздействию прямых солнечных лучей.
Этап А. Подготовка к введению
Перед началом введения пациенту понадобятся:
- шприц с препаратом Пралуэнт;
- салфетки, смоченные спиртом;
- ватные тампоны или марля;
- контейнер, резистентный к проколам.
1. Перед началом следует:
- взять шприц из пакета, удерживая его за корпус.
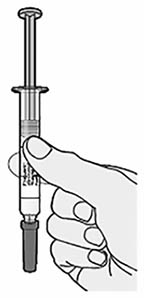
2. Проверить этикетку на шприце:
- проверить, что взят правильный (нужный пациенту) препарат и правильная (нужная пациенту) доза (шприц с зеленым поршнем — для дозы 75 мг/мл и шприц с серым поршнем — для дозы 150 мг/мл);
- проверить срок годности, не использовать по истечении срока годности;
- проверить, чтобы жидкость в шприце была прозрачной и бледно-желтой, без включений. Если имеются изменения цвета и видимые включения, то не следует использовать шприц;
- проверить, что шприц не открыт и не поврежден.
3. Оставить шприц согреваться при комнатной температуре в течение 30–40 мин:
- не нагревать шприц, он должен согреться сам;
- использовать шприц как можно скорее после того, как он согреется;
- не класть шприц обратно в холодильник.
4. Подготовка места введения:
- вымыть руки водой и мылом и вытереть их полотенцем;
- можно вводить препарат в область бедра, живота (за исключением области 5 см вокруг пупка), наружную поверхность плеча (см. рисунок);
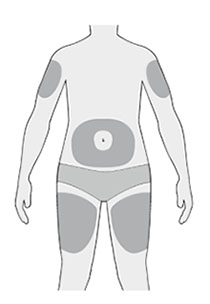
- пациент может стоять или сидеть во время введения препарата;
- продезинфицировать место введения салфеткой, смоченной спиртом;
- не вводить препарат в болезненную, уплотненную, покрасневшую или воспаленную кожу;
- не вводить препарат в места рядом с видимыми венами;
- использовать разные места при каждом введении препарата.
Этап B. Как вводить препарат
1. После завершения всех пунктов «Этап А. Подготовка к введению» снять колпачок для иглы:
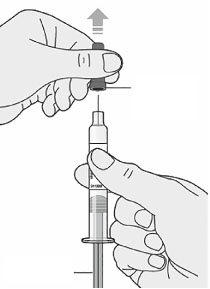
- не снимать колпачок до тех пор, пока пациент не будет готов к введению препарата;
- держать шприц за середину корпуса так, чтобы игла была направлена от пациента;
- не прикасаться к поршню;
- пациент может увидеть пузырьки воздуха. Это нормальное явление, не влияет на дальнейшее использование препарата. Не следует избавляться ни от каких пузырьков в шприце до начала инъекции;
- не надевать серый колпачок обратно.
2. При необходимости зажать кожу:
- большим и указательным пальцем зажать кожу так, чтобы получилась складка кожи в месте введения;
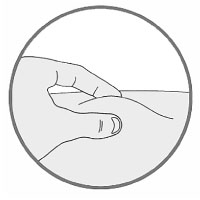
- удерживать кожную складку во время проведения всей инъекции.
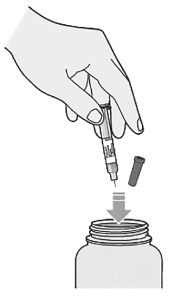
3. Ввести иглу в складку кожи быстрым движением:
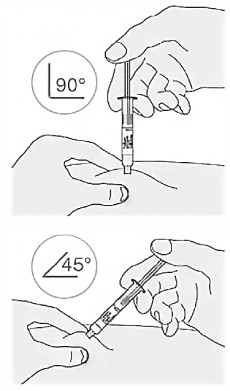
- использовать угол в 90° при сжатии 5 см кожи; использовать угол в 45° при сжатии 2 см кожи.
4. Опустить поршень вниз:
- ввести весь раствор медленным и равномерным нажатием на поршень;
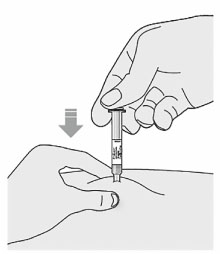
5. Перед тем как удалить иглу, следует убедиться, что шприц пуст:
- не удалять шприц, пока он полностью не опустеет;
- вытаскивать иглу из кожи следует под тем же углом, под каким она была введена;
- не растирать кожу после введения препарата;
- если видна кровь, необходимо прижать ватный тампон или марлю и удерживать их до тех пор, пока не остановится кровотечение.
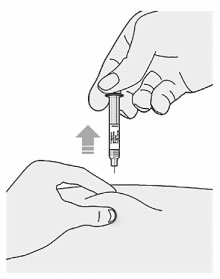
6. Утилизировать шприц и колпачок:
- не надевать серый колпачок повторно;
- не использовать шприц повторно;
- поместить шприц в контейнер, резистентный к проколам;
- всегда хранить контейнер в недоступном для детей месте.
Подготовка и обращение с препаратом
- пациент может вводить препарат Пралуэнт самостоятельно, или препарат может быть введен лицом, ухаживающим за пациентом, после предоставления им медицинскими работниками информации по правильной технике проведения п/к инъекций;
- препараты для парентерального введения должны осматриваться визуально перед введением на предмет наличия видимых частиц и изменения цвета. Если раствор имеет измененный цвет или видимые частицы, его не следует использовать;
- перед использованием предварительно заполненных шприц-ручек и предварительно заполненных шприцев следует согреть их до комнатной температуры;
- препарат Пралуэнт следует использовать как можно скорее, после того как он согреется. Препарат может храниться не более 24 ч при температуре не выше 25 °C;
- после использования шприц-ручки и шприцы следует поместить в резистентный к проколам контейнер и утилизировать согласно местным (государственным) требованиям;
- не использовать контейнер повторно;
- всегда следует хранить контейнер в местах, недоступных для детей;
- пациенты и ухаживающие за ними лица должны получить руководство по надлежащей технике п/к введения, включая сведения по асептике, и по тому, как правильно использовать предварительно заполненные шприц-ручки и предварительно заполненные шприцы;
- пациентов и ухаживающих за ними лиц следует информировать о том, что перед первым введением препарата Пралуэнт они должны внимательно прочитать инструкцию по применению препарата;
- пациентов и ухаживающих за ними лиц следует предупредить, что запрещено повторное использование шприц-ручек или шприцев, и они должны быть проинструктированы, как безопасно утилизировать их после использования.
Применение при беременности и кормлении грудью
Отсутствуют данные по применению препарата Пралуэнт у беременных женщин. Ожидается, что алирокумаб, как и другие антитела класса IgG, проникает через плацентарный барьер. Во время беременности применение препарата Пралуэнт противопоказано.
Неизвестно, проникает ли алирокумаб в грудное молоко у человека. В связи с тем, что многие лекарственные препараты, в т.ч. IgG, проникают в грудное молоко у человека, применение препарата Пралуэнт у женщин в период грудного вскармливания противопоказано. При необходимости применения препарата Пралуэнт в данный период следует прекратить грудное вскармливание.
Пралуэнт: Противопоказания
повышенная чувствительность к алирокумабу или какому-либо вспомогательному веществу препарата;
беременность (эффективность и безопасность не установлены);
период грудного вскармливания (эффективность и безопасность не установлены);
детский возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью: почечная недостаточность тяжелой степени; печеночная недостаточность тяжелой степени.
Пралуэнт: Побочные действия
Представленные ниже данные по безопасности отражают применение алирокумаба у 3340 пациентов, большинство из которых имели высокий или очень высокий риск развития сердечно-сосудистых заболеваний, получали алирокумаб в дозе 75 или 150 мг в виде п/к инъекций 1 раз в 2 нед с продолжительностью лечения до 18 мес (включая 2408 пациентов, получавших лечение алирокумабом в течение 52 нед, и 639 пациентов, получавших лечение алирокумабом в течение не менее 76 нед). Данные по безопасности основаны на объединенных результатах 9 плацебо-контролируемых исследований (4 исследования II фазы и 5 исследований III фазы (все исследования у пациентов, одновременно принимающих статины) и 5 контролируемых эзетимибом исследований III фазы (в 3 из которых пациенты одновременно принимали статины).
Наиболее частыми нежелательными реакциями (≥1% пациентов, получавших препарат Пралуэнт) были реакции в месте введения препарата, субъективные симптомы и объективные признаки со стороны верхних дыхательных путей и кожный зуд.
Наиболее частыми нежелательными реакциями, приводящими к прекращению лечения у пациентов, получавших препарат Пралуэнт, были реакции в месте введения препарата.
Не наблюдалось различий в отношении профиля безопасности между двумя дозами (75 мг 1 раз в 2 нед и 150 мг 1 раз в 2 нед), использованными в программе клинических исследований III фазы.
В контролируемых исследованиях возраст 1158 пациентов (34,7%), получавших препарат Пралуэнт, составлял ≥65 лет, возраст 241 пациента (7,2%), получавшего препарат Пралуэнт, составлял ≥75 лет. Не наблюдалось достоверных различий по безопасности и эффективности препарата по мере увеличения возраста пациентов.
Нежелательные реакции, о которых сообщалось при применении препарата Пралуэнт в объединенных контролируемых исследованиях
Нежелательные реакции представлены в соответствии с частотой, классификация которой рекомендована ВОЗ: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1 000 до <1/100); редко (от ≥1/10 000 до <1/1000); очень редко (<1/10000); частота неизвестна (частота не может быть определена на основании имеющихся данных).
Со стороны иммунной системы: редко — гиперчувствительность, аллергический васкулит.
Со стороны дыхательной системы, органов грудной клетки и средостения: часто — субъективные симптомы и объективные признаки со стороны верхних дыхательных путей, включая боль в ротоглотке, ринорею, чихание.
Со стороны кожи и подкожных тканей: часто — кожный зуд; редко — крапивница, монетовидная экзема.
Общие расстройства и нарушения в месте введения: часто — реакции в месте введения препарата, включая эритему/гиперемию, кожный зуд, отек, боль/болезненную чувствительность.
Описание отдельных нежелательных реакций
Реакции в месте введения препарата. Реакции в месте введения препарата, включая эритему/гиперемию, кожный зуд, отек, боль/болезненную чувствительность, отмечались у 6,1% пациентов, получавших лечение алирокумабом, по сравнению с 4,1% в контрольной группе. Большинство реакций в месте введения препарата были преходящими и слабо выраженными. Частота прекращения лечения вследствие развития реакций в месте введения была сопоставимой в обеих группах (0,2% в группе алирокумаба по сравнению с 0,3% в контрольной группе).
Генерализованные аллергические реакции. Генерализованные аллергические реакции чаще отмечались в группе алирокумаба, чем в контрольной группе, главным образом с различием в частоте развития кожного зуда. Кожный зуд был обычно слабо выраженным и преходящим. Кроме этого, в контролируемых клинических исследованиях сообщалось о развитии редких и иногда серьезных аллергических реакций, таких как реакции гиперчувствительности, монетовидная экзема, крапивница и аллергический васкулит.
Исследование с использованием режима дозирования 300 мг 1 раз каждые 4 нед
Профиль безопасности у пациентов, получавших режим дозирования 300 мг 1 раз в 4 нед, был аналогичен профилю безопасности с использованием режима дозирования каждые 2 нед, за исключением более высокой частоты развития реакций в местах инъекции. Реакции в месте инъекции препарата были зарегистрированы с частотой 16,6% в группе режима дозирования 300 мг 1 раз в 4 нед лечения и 7,9% в группе плацебо. Частота прекращения применения препарата из-за реакций в месте инъекции составляла 0,7% в группе режима дозирования 300 мг 1 раз в 4 нед лечения и 0% в группе плацебо.
Значения Хс-ЛПНП <25 мг/дл. В объединенных контролируемых исследованиях у 796 из 3340 пациентов (23,8%), получавших лечение препаратом Пралуэнт, отмечались два последовательно полученных значения концентрации Хс-ЛПНП в крови <25 мг/дл, включая 288 пациентов (8,6%) с двумя последовательно полученными значениями концентрации Хс-ЛПНП <15 мг/дл.
Эти случаи главным образом наблюдались, когда пациенты начинали и продолжали лечение препаратом Пралуэнт в дозе 150 мг 1 раз в 2 нед, независимо от исходных значений концентрации Хс-ЛПНП в крови или реакции на лечение.
В исследовании с использованием режима дозирования каждые 4 нед у 113 из 458 пациентов (24,7%), получавших лечение препаратом Пралуэнт в дозах 300 мг каждые 4 нед/150 мг каждые 2 нед, отмечались два последовательно полученных значения концентрации ХС-ЛПНП в крови <25 мг/дл, и у 45 из 458 пациентов (9,8%) отмечались два последовательно полученных значения концентрации Хс-ЛПНП в крови <15 мг/дл.
Не было выявлено нежелательных реакций, связанных с этими значениями концентрации Хс-ЛПНП в крови.
Сердечно-сосудистые осложнения. В настоящее время продолжается исследование сердечно-сосудистых исходов, в котором главной конечной точкой являются подтвержденные экспертизой большие нежелательные сердечно-сосудистые осложнения (БНССО), такие как коронарная смерть, инфаркт миокарда, ишемический инсульт и нестабильная стенокардия, потребовавшая госпитализации.
В заранее запланированном объединенном анализе данных исследований III фазы у 110 пациентов (3,5%) в группе алирокумаба и 53 пациентов (3%) в контрольной группе (плацебо или активный контроль) наблюдались следующие, подтвержденные экспертизой, сердечно-сосудистые осложнения, развившиеся во время лечения: смерть, связанная с ИБС, инфаркт миокарда, ишемический инсульт, нестабильная стенокардия, потребовавшая госпитализации, госпитализация по поводу ХСН и реваскуляризация. Подтвержденные БНССО наблюдались у 52 из 3182 пациентов (1,6%) в группе алирокумаба и у 33 из 1792 пациентов (1,8%) в контрольной группе (плацебо и активный контроль).
В заранее запланированном окончательном анализе клинического исследования LONG TERM подтвержденные экспертизой сердечно-сосудистые осложнения, развившиеся во время лечения, наблюдались у 72 из 1550 пациентов (4,6%) в группе алирокумаба и у 43 из 788 пациентов (5,1%) в группе плацебо; подтвержденные экспертизой БНССО наблюдались у 27 из 1550 пациентов (1,7%) в группе алирокумаба и у 26 из 788 пациентов (3,3%) в группе плацебо. Отношения рисков (ОР) рассчитывали ретроспективно; для всех сердечно-сосудистых осложнений ОР = 0,91 (95% ДИ: 0,62–1,34); для БНССО ОР = 0,52 (95% ДИ: 0,31–0,9).
Смертность от всех причин. В клинических исследованиях III фазы смертность от всех причин составляла 0,6% (20 из 3182 пациентов) в группе алирокумаба и 0,9% (17 из 1792 пациентов) в контрольной группе. Главной причиной смертельных исходов были сердечно-сосудистые осложнения.
Иммуногенность/антитела к алирокумабу. Как и все другие протеины, применяющиеся для лечения, алирокумаб обладает потенциальной иммуногенностью. В исследованиях III фазы у 4,8% пациентов, получавших лечение алирокумабом, отмечалось образование антител к алирокумабу (АА) по сравнению с 0,6% в контрольной группе (плацебо и эзетимиб). У большинства этих пациентов наблюдались преходящие реакции образования АА с низкими титрами без нейтрализующей активности. По сравнению с пациентами, которые были АА-негативными, пациенты с АА-позитивным статусом не продемонстрировали различий в системной экспозиции алирокумаба, эффективности или безопасности, за исключением более высокой частоты развития реакций в месте введения препарата. Только у 1,2% пациентов в группе алирокумаба были выявлены нейтрализующие антитела. Большинство этих пациентов имело только один положительный результат анализа на наличие нейтрализующих антител; 10 пациентов (0,3%) имели два или более положительных результата анализа на наличие нейтрализующих антител. Данные у этих пациентов не подтверждают корреляции между наличием нейтрализующих антител и эффективностью в отношении снижения концентрации Хс-ЛПНП в крови и безопасностью.
В исследовании с использованием режима дозирования каждые 4 нед у 4,7% пациентов, получавших лечение алирокумабом в дозах 300 мг 1 раз каждые 4 нед/150 мг каждые 2 нед, наблюдалось образование антител к алирокумабу по сравнению с 2,6% пациентов, получавших плацебо. В этом исследовании у пациентов, которые получали лечение алирокумабом и у которых образовались антитела к алирокумабу, наблюдалась более низкая частота развития реакций в месте введения препарата по сравнению с пациентами, у которых не образовывались антитела к алирокумабу (8,6% против 16,2%). У 0,4% пациентов, получавших лечение алирокумабом в дозах 300 мг каждые 4 нед/150 мг каждые 2 нед, выявлялось развитие нейтрализующих антител, по крайней мере однократно, без потери эффективности; не наблюдалось образование нейтрализующих антител у пациентов контрольной группы.
Данные по иммуногенности зависят от чувствительности и специфичности методики их определения, а также от других факторов. Кроме этого, на наблюдаемую частоту АА-позитивного результата анализа оказывают влияние несколько факторов, включая обработку забранных проб крови, время забора крови, одновременно принимаемые лекарственные препараты и основное заболевание. По этим причинам сравнение частоты возникновения АА с частотой возникновения антител к другим препаратам может быть некорректным.
Передозировка
В контролируемых клинических исследованиях не было выявлено никаких изменений безопасности при более частом введении доз, чем рекомендованный режим дозирования 1 раз в 2 нед.
Взаимодействие
Влияние алирокумаба на другие ЛС. Так как алирокумаб является биологическим веществом, не ожидается каких-либо фармакокинетических эффектов алирокумаба на другие лекарственные препараты.
В клинических исследованиях при применении алирокумаба в комбинации с аторвастатином или розувастатином не наблюдалось каких-либо значимых изменений концентраций статинов в крови при повторных введениях алирокумаба, что указывает на то, что алирокумаб не влияет на изоферменты цитохрома P450 (главным образом изоферменты CYP3A4 и CYP2C9) и белки-транспортеры, такие как P-gp и OATP (белок транспортер органических анионов).
Влияние других ЛС на алирокумаб. Статины и другая липидмодифицирующая терапия, как известно, повышают синтез PCSK9, белка, являющегося мишенью алирокумаба. Повышение концентрации PCSK9 может привести к уменьшению системной экспозиции алирокумаба. Однако это не влияет на продолжительность действия препарата при применении алирокумаба 1 раз в 2 нед.
Особые указания
Аллергические реакции. В клинических исследованиях сообщалось о развитии генерализованных аллергических реакций, включая зуд; также имелись сообщения о редких и иногда серьезных случаях аллергических реакций, таких как реакции гиперчувствительности, монетовидная экзема, крапивница и аллергический васкулит. При появлении симптомов и признаков серьезных аллергических реакций лечение препаратом Пралуэнт следует прекратить, и начать проведение соответствующей симптоматической терапии.
Влияние на фертильность. Данные о неблагоприятном воздействии алирокумаба на фертильность отсутствуют.
Пожилые пациенты. Данные о применении алирокумаба у пациентов >75 лет ограничены. В контролируемых исследованиях возраст 1158 пациентов (34,7%), получавших препарат Пралуэнт, составлял >65 лет, и возраст 241 пациента (7,2%), получавшего препарат Пралуэнт, составлял >75 лет. Значимых различий в безопасности и эффективности препарата Пралуэнт с увеличением возраста не наблюдалось.
Почечная недостаточность. В клинических исследованиях количество пациентов с почечной недостаточностью тяжелой степени (Cl креатинина <30 мл/мин/1,73 м2) было ограничено. Препарат Пралуэнт следует применять с осторожностью у пациентов с почечной недостаточностью тяжелой степени (см. С осторожностью).
Печеночная недостаточность. Исследований алирокумаба у пациентов с печеночной недостаточностью тяжелой степени (класс С по шкале Чайлд-Пью) не проводились. Препарат Пралуэнт следует применять с осторожностью у данной категории пациентов (см. С осторожностью).
Влияние на способность управлять транспортными средствами и механизмами. Препарат Пралуэнт не влияет или почти не влияет на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Раствор для подкожного введения, 75 мг/мл и 150 мг/мл. По 1 мл в одноразовом шприце из прозрачного стекла (тип 1), снабженном несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого полимера. По 1 шприцу в пластиковом блистере с покрытием. По 1 бл., 2 соединенных бл., или 3 пары соединенных бл. помещают в картонную пачку. По 1 шприцу помещают в шприц-ручку. По 1, 2 или 6 шприц-ручек помещают в картонную пачку, снабженную фиксатором.
Условия хранения
Хранить при температуре от 2°С до 8°С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Производитель
Санофи Винтроп Индустрия, Франция (шприцы).
Фасовщик (первичная упаковка). Санофи Винтроп Индустрия, Франция (шприцы).
Упаковщик (вторичная (потребительская) упаковка). Санофи Винтроп Индустрия, Франция (шприцы).
Санофи-Авентис Дойчланд ГмбХ, Германия (шприц-ручки).
ЗАО «Санофи-Авентис Восток», Россия (шприц-ручки).
Выпускающий контроль качества. Санофи Винтроп Индустрия, Франция (шприцы). Sanofi Winthrop Industrie, France. 1051, boulevard Industriel, 76580 Le Trait, France.
Санофи-Авентис Дойчланд ГмбХ, Германия (шприц-ручки). Sanofi-Aventis Deutschland GmbH, Germany. Brueningstrasse 50/Industriepark Hoechst H500, H590, H600 65926 Frankfurt am Main, Germany.
ЗАО «Санофи-Авентис Восток», Россия (шприц-ручки). 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Претензии потребителей направлять по адресу в России. Представительство АО «Санофи-авентис груп». 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
В случае упаковки препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу. 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Тел./факс: (486) 2-44-00-55.
Юридическое лицо, на имя которого выдано регистрационное удостоверение. АО Санофи-авентис груп, Франция.
Характеристики
Отзывы о Пралуэнт
Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .